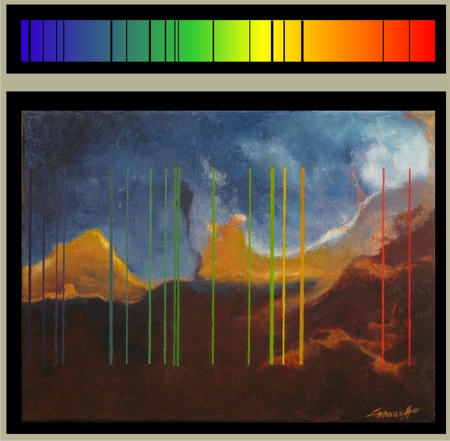
Nebulae - Spectre de l'hydrogène - 2013
Media mixtes, 12" x 16" + 2" x 16"
La bande colorée au-dessus de chaque tableau représente le spectre de la lumière visible. On observe ceci lorsque la lumière traverse un prisme. Les différentes longueurs d'ondes (couleurs) sont divisées par réfraction et on obtient une séquence allant du rouge au bleu.
Planck et Einstein avaient déterminé que les atomes (les électrons des atomes) n'absorbent et n'émettent de l'énergie qu'en petits "paquets", appelés "quanta", et qu'à certaines longueurs d'ondes qui leurs sont propres. Ces longueurs d'ondes se traduisent par de fines lignes noires, où l'énergie n'est pas transmise avec le reste de la lumière, mais absorbée par les atomes. Ces lignes, le Spectre d'absorption, constituent une véritable signature qui permet d'identifier les gaz et les poussières contenus dans les étoiles et les nébuleuses.
Vous remarquerez que bien que l'hydrogène n'ait qu'un seul électron, son spectre compte quatre lignes. C'est que cet électron peut se placer sur quatre orbites différentes autour du noyau. Quatre lignes, donc, quatre niveaux différents d'énergie. Et plus L'atome est lourd, plus son spectre compte de lignes.
Nebulae - Hydrogen Spectrum - 2013
Mixed Media, 12" x 16" + 2" x 16"
The coloured band above each painting represents the spectrum of visible light. This is observed when light is divided by a prism. The various wavelengths (colours) are divided by refraction and we obtain a sequence going from red to blue. Planck and Einstein had determined that each atom can only absorb or emit energy in individual little packets called quanta, and only at certain wavelengths specific to each element.
These wavelengths result in fine black lines where energy is absorbed by the atoms instead of being transmitted with the rest of the light. This Absorption Spectrum constitutes a true signature which allows us to identify compounds present in stars and nebulae.
You will notice that, though Hydrogen only has one electron, its spectrum shows four lines. This is because this single electron can jump to four different orbits around the nucleus, depending on its level of energy. And the heavier the atom, the more lines in its spectrum.

Nebulae - Spectre de l'hélium - 2013
Huile sur toile, 12" x 16" + 2" x 16"
Nebulae - Helium Spectrum - 2013
Mixed Media, 12" x 16" + 2" x 16"

Nebulae - Spectre du carbone - 2013
Huile sur toile, 12" x 16" + 2" x 16"
Nebulae - Carbon Spectrum - 2013
Mixed Media, 12" x 16" + 2" x 16"
|